Los gases son sustancias que se caracterizan por su capacidad de expandirse y ocupar todo el espacio disponible. A lo largo de la historia, los científicos han estudiado el comportamiento de los gases y han desarrollado una serie de leyes que nos permiten entender cómo se comportan en diferentes situaciones. En este artículo, exploraremos las leyes de los gases más importantes y daremos ejemplos para su mejor comprensión.

¿Qué son las leyes de los gases?
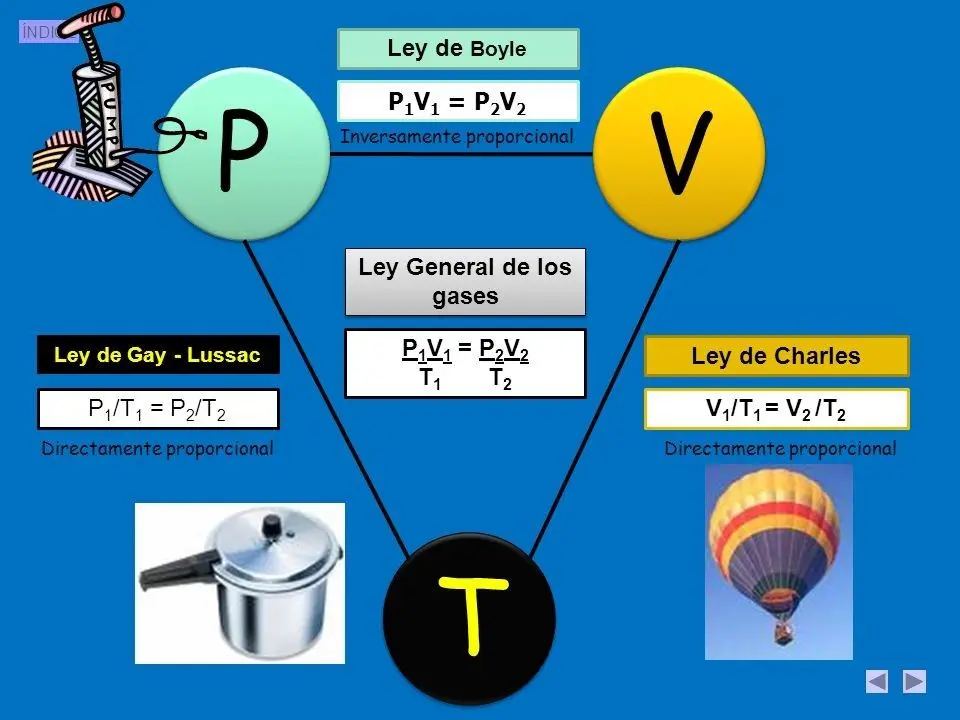
Las leyes de los gases son principios fundamentales que describen el comportamiento de los gases en condiciones específicas. Estas leyes se basan en observaciones experimentales y permiten predecir cómo se comportarán los gases en diferentes situaciones. Las leyes de los gases más conocidas son la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro.
¿Qué es la ley de Charles y ejemplos?
La ley de Charles establece que, a presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta. En otras palabras, si calentamos un gas, su volumen aumentará y si lo enfriamos, su volumen disminuirá, siempre y cuando la presión se mantenga constante.
Un ejemplo común de la ley de Charles es el de un globo inflado con gas. Si calentamos el globo, el gas dentro de él se expandirá, lo que hará que el globo aumente de tamaño. Por el contrario, si enfriamos el globo, el gas se contraerá y el globo disminuirá de tamaño.
¿Cuáles son las leyes de Boyle y Gay-Lussac?
La ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Esto significa que si aumentamos la presión de un gas, su volumen disminuirá, y si disminuimos la presión, su volumen aumentará.
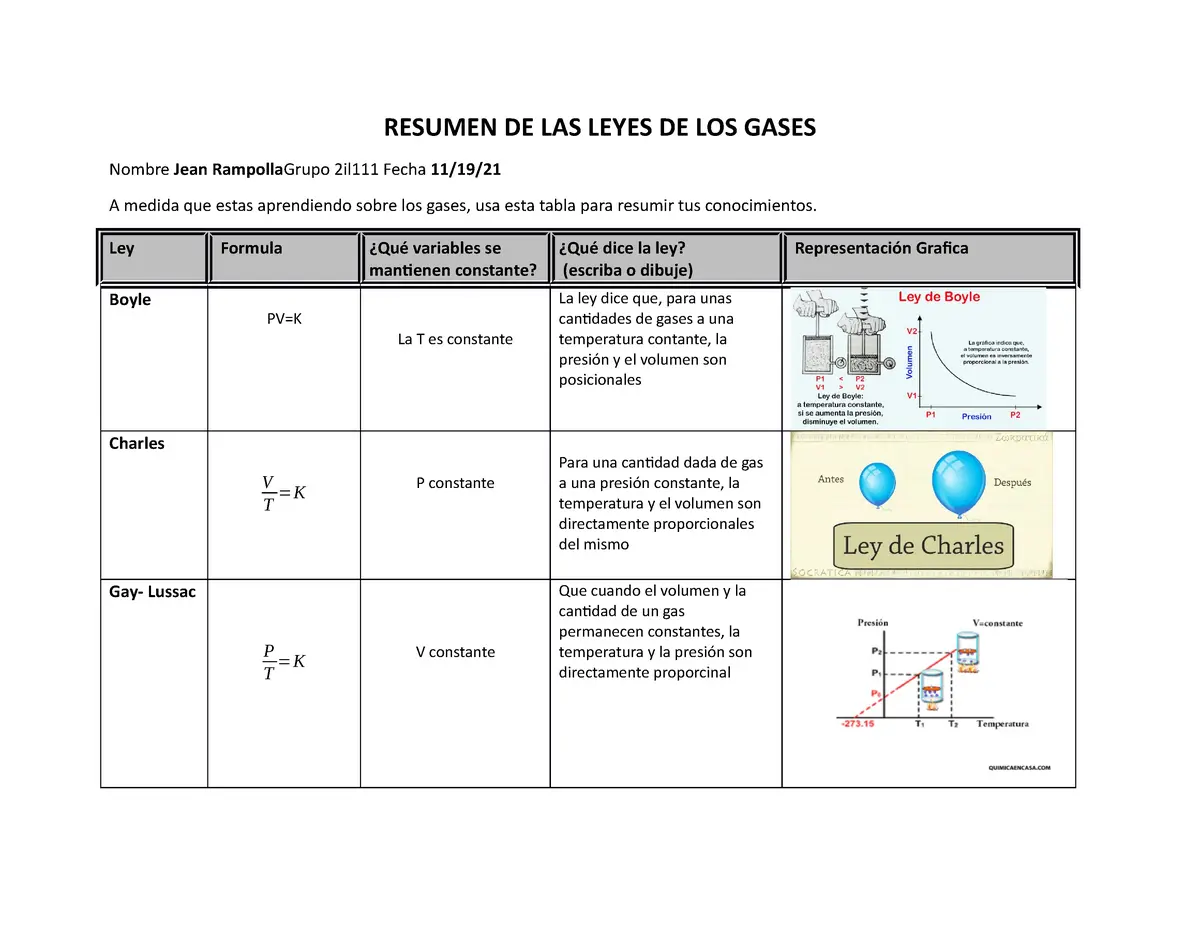
Por otro lado, la ley de Gay-Lussac establece que, a volumen constante, la presión de un gas es directamente proporcional a su temperatura absoluta. En otras palabras, si aumentamos la temperatura de un gas, su presión también aumentará, y si disminuimos la temperatura, su presión disminuirá.
¿Qué es la ley de Avogadro y cómo se aplica?
La ley de Avogadro establece que, a igual temperatura y presión, volúmenes iguales de gases diferentes contienen el mismo número de moléculas. Esto significa que si tenemos dos gases diferentes en las mismas condiciones de temperatura y presión, sus volúmenes serán proporcionales a la cantidad de moléculas presentes.
Un ejemplo de la ley de Avogadro es el siguiente: si tenemos un recipiente con 2 litros de helio y otro recipiente con 2 litros de oxígeno, ambos a la misma temperatura y presión, la cantidad de moléculas de helio será la misma que la cantidad de moléculas de oxígeno.
Consultas habituales
- ¿Cuáles son las leyes de los gases más importantes?
- Las leyes de los gases más importantes son la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro.
- ¿Qué establece la ley de Charles?
- La ley de Charles establece que, a presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta.
- ¿Qué establece la ley de Boyle?
- La ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión.
- ¿Qué establece la ley de Gay-Lussac?
- La ley de Gay-Lussac establece que, a volumen constante, la presión de un gas es directamente proporcional a su temperatura absoluta.
- ¿Qué establece la ley de Avogadro?
- La ley de Avogadro establece que, a igual temperatura y presión, volúmenes iguales de gases diferentes contienen el mismo número de moléculas.
Las leyes de los gases son herramientas fundamentales para comprender el comportamiento de estos en diferentes situaciones. La ley de Charles nos dice que el volumen de un gas es proporcional a su temperatura, la ley de Boyle establece que el volumen de un gas es inversamente proporcional a su presión, la ley de Gay-Lussac establece que la presión de un gas es proporcional a su temperatura, y la ley de Avogadro nos dice que volúmenes iguales de gases diferentes contienen el mismo número de moléculas. Estas leyes nos permiten predecir y entender el comportamiento de los gases en diversas situaciones y son fundamentales en el estudio de la química y la física.

