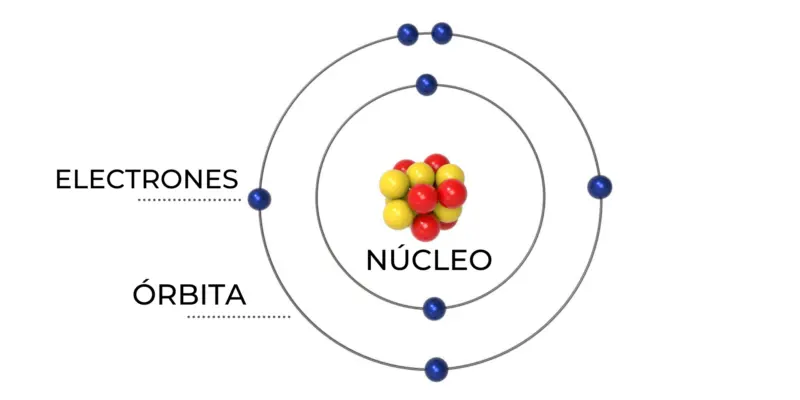
El modelo atómico de Bohr, propuesto por Niels Bohr en 1913, fue el resultado de importantes investigaciones realizadas por varios científicos a finales del siglo XIX y principios del siglo XX. Este modelo revolucionario permitió formular la primera hipótesis concreta sobre la estructura de la materia.
El átomo de Bohr
Basándose en el modelo de Rutherford, Bohr planteó que el átomo de hidrógeno está compuesto por un núcleo formado por una partícula positiva, alrededor del cual gira un electrón. Este modelo se asemeja al sistema solar, donde el núcleo es el sol y los electrones son los planetas. Bohr utilizó las leyes de Newton y de Coulomb para igualar la fuerza centrípeta con la electrostática.
La fuerza coulombiana de atracción electrostática entre dos cargas q y q' en un medio de constante dieléctrica o permisividad al vacío ε o, viene dada por:

F = (k * q * q') / r^2
Donde k es la constante de Coulomb y r es la distancia entre las cargas.
Considerando que la carga del electrón es igual a la carga del protón, representada por la letra e, y omitiendo la constante 1/4πε o, podemos escribir:
F = e^2 / (4πε o * r^2)
Para igualar la fuerza centrípeta (F n) que actúa sobre el electrón en su movimiento circular alrededor del núcleo, con la fuerza electrostática, se obtiene la siguiente ecuación:
(e^2 / (4πε o * r^2)) = (m * v^2) / r
Donde m es la masa del electrón y v es su velocidad.
A partir de esta ecuación, Bohr dedujo que solo ciertos valores de velocidad y radio son posibles para los electrones en el átomo de hidrógeno. Estos valores están determinados por el primer postulado de Bohr:
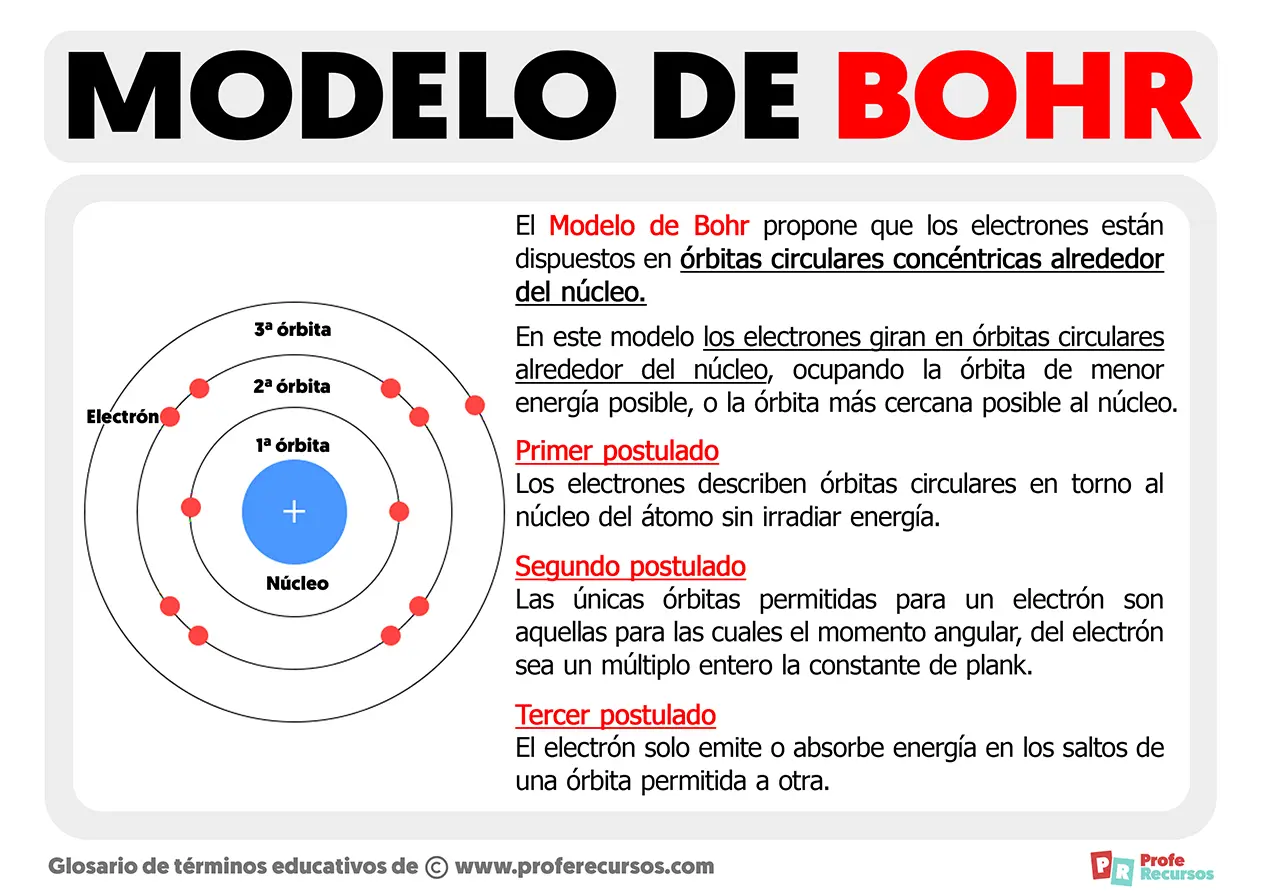
Primer postulado de Bohr
Los electrones del átomo solo pueden encontrarse en determinados orbitales para los cuales el momento angular es un múltiplo entero de h/2π, siendo h la constante de Planck.
Esto implica que los electrones solo pueden ocupar orbitales cuyas velocidades cumplen la relación:
v = (n * h) / (2π * m * r)
Donde n es un número entero positivo que representa el nivel de energía del electrón.
Conociendo el valor de la velocidad, podemos determinar el radio de la órbita del electrón utilizando la ecuación:
r = (h^2 * ε o) / (π * m * e^2 * n^2)
De esta manera, el primer postulado de Bohr establece los posibles orbitales en los que los electrones pueden encontrarse. El primer orbital corresponde a n = 1, el segundo a n = 2, y así sucesivamente.
Calculando la energía total (E n) del electrón en cada orbital, sumando su energía cinética (E c) y su energía potencial (E p), obtenemos:
E n = E c + E p
La energía cinética se calcula mediante la ecuación:

E c = (m * v^2) / 2
Y la energía potencial se calcula mediante la ecuación de la fuerza electrostática:
E p = - (e^2 / (4πε o * r))
Finalmente, la energía total del electrón en cada orbital se determina mediante la ecuación:
E n = - (m * e^4 * ε o^2) / (32π^2 * h^2 * n^2)
Donde n es el nivel de energía del electrón.
Comentarios sobre el modelo de Bohr
Si bien el modelo atómico de Bohr fue un avance significativo en el entendimiento de la estructura del átomo, tiene limitaciones cuando se aplica a átomos diferentes del hidrógeno. Las discrepancias entre las longitudes de onda de los espectros emitidos y los cálculos teóricos fueron evidencias de que este modelo no representaba completamente la realidad de la naturaleza.
A pesar de estas limitaciones, el modelo de Bohr sentó las bases para el desarrollo de la Mecánica Cuántica, que proporciona una explicación más completa de la estructura del átomo. La Mecánica Cuántica utiliza conceptos más amplios y complejos para describir el comportamiento de los electrones en los átomos.

El modelo atómico de Bohr fue un hito en la historia de la química y sentó las bases para futuros avances en el entendimiento de la estructura de la materia. Aunque ha sido superado por la Mecánica Cuántica, el modelo de Bohr sigue siendo importante para comprender los conceptos fundamentales de la teoría atómica.